 联系我们
联系我们
 18210828691
18210828691
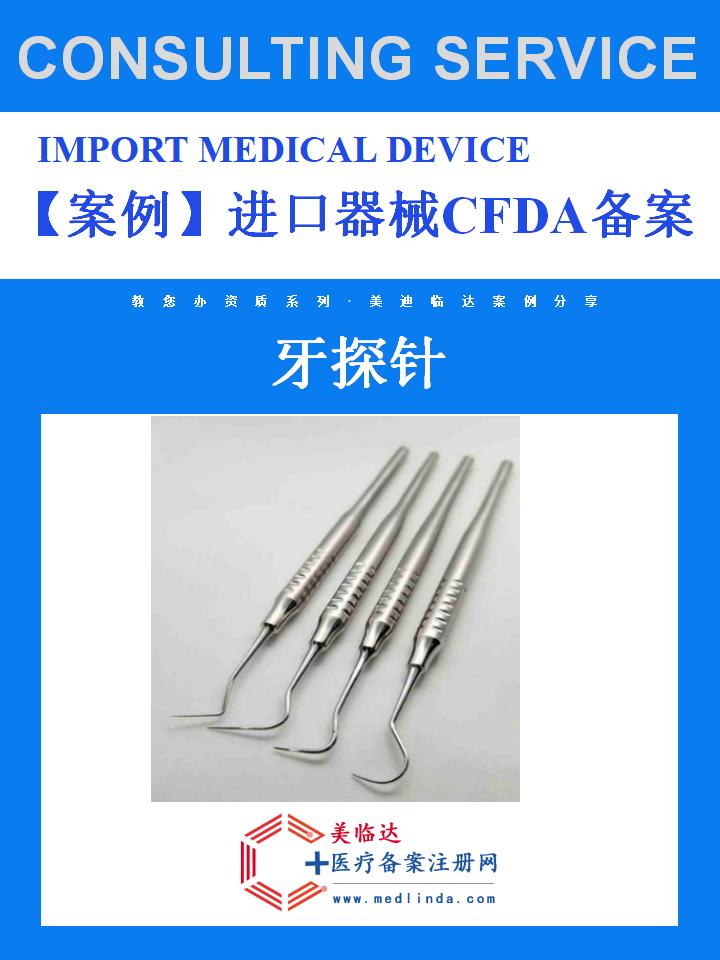



【案例】办理牙探针进口CFDA备案攻略:流程、资料与周期全解析
在医疗科技日新月异的今天,牙探针作为口腔诊疗中不可或缺的工具,其性能与质量直接关系到患者的治疗体验和医生的诊断准确性。随着国际医疗技术的交流与融合,进口牙探针因其先进的技术和卓越的品质,逐渐受到国内市场的青睐。然而,进口牙探针进入中国市场前,必须通过国家药品监督管理局(现更名为国家药品监督管理局药品审评中心,简称CDE,但习惯上仍沿用CFDA的说法)的严格备案审核。本文将以实际案例为基础,结合#医疗器械进口合规#、#口腔医疗技术创新#等热门话题,为您详细解析办理牙探针进口CFDA备案的流程、所需资料及预计周期,助您轻松跨越这一重要门槛。
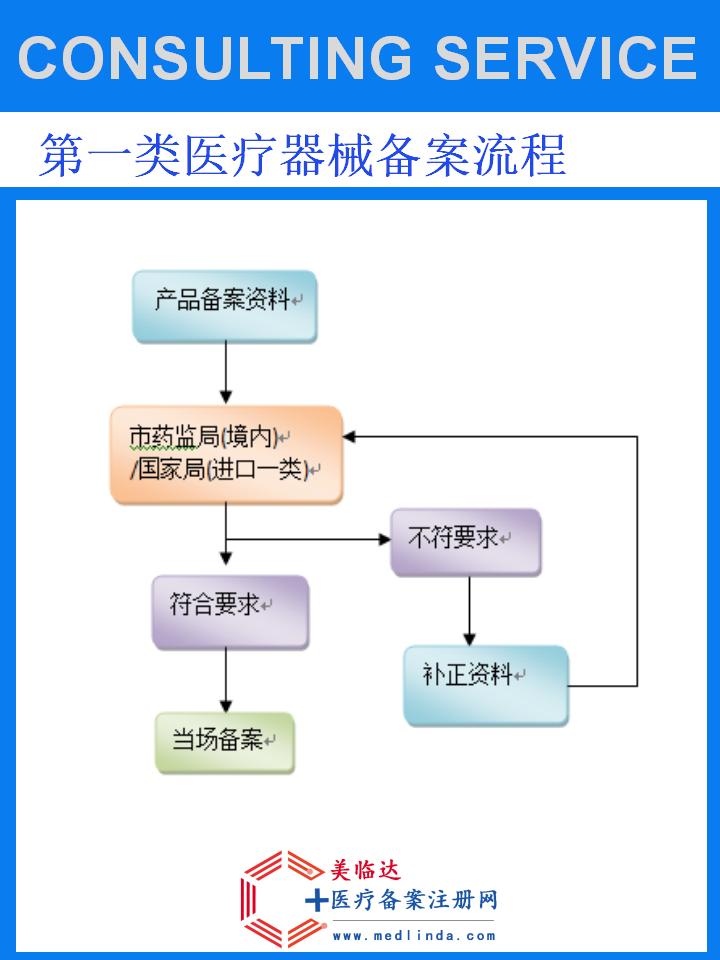
牙探针进口CFDA备案,是指将国外生产的牙探针产品引入中国市场前,需按照《医疗器械监督管理条例》及其实施细则等相关法律法规,向CDE提交一系列申请资料,经过严格的技术审评、质量管理体系考核等程序,最终获得产品在中国境内合法销售和使用的许可。这一过程不仅是产品质量的保证,也是维护国内医疗市场秩序、保障患者安全的重要措施。
随着口腔医疗技术的不断进步和患者对治疗品质要求的提高,进口牙探针以其高精度、高耐用性和良好的生物相容性,成为众多口腔医疗机构的首选。然而,面对繁琐的进口备案流程、严格的质量标准和不断变化的政策环境,如何高效、准确地完成备案手续,成为进口商关注的焦点。
办理牙探针进口CFDA备案的周期因多种因素而异,包括但不限于申请资料的准备情况、产品特性的复杂程度、审评过程中的补充要求以及政策变动等。一般来说,从提交申请到获得备案凭证,整个流程可能需要数月至一年不等的时间。因此,建议进口商提前规划,预留足够的时间以确保备案工作的顺利进行。
在#医疗器械进口合规#和#口腔医疗技术创新#的大潮中,办理牙探针进口CFDA备案是进口商进入中国市场的重要一步。通过本文的详细解析与策略建议,我们希望能够为进口商提供全面的指导和支持,助力其顺利完成备案手续,将优质的进口牙探针产品引入中国市场。