|
了解美临达 美临达医疗,专注于企业资质咨询,可提供ISO体系认证、医疗器械化妆品、消毒产品、食品相关资质及配套服务。 |
 |
专业的服务团队 美临达医疗拥有一支专业的技术服务团队,平均行业经验5年以上,人员素质良好,可提供优质的服务。 |
 |
合理的费用预算 美临达医疗,通过提高团队效率,压缩服务成本,降低服务报价,为客户提供质优价廉的专业服务。 |
 |
良好的售后体验 美临达医疗承诺售后服务,均可良好兑现,为客户提供更多咨询、工具和参考意见,帮助客户解决更多问题。 |
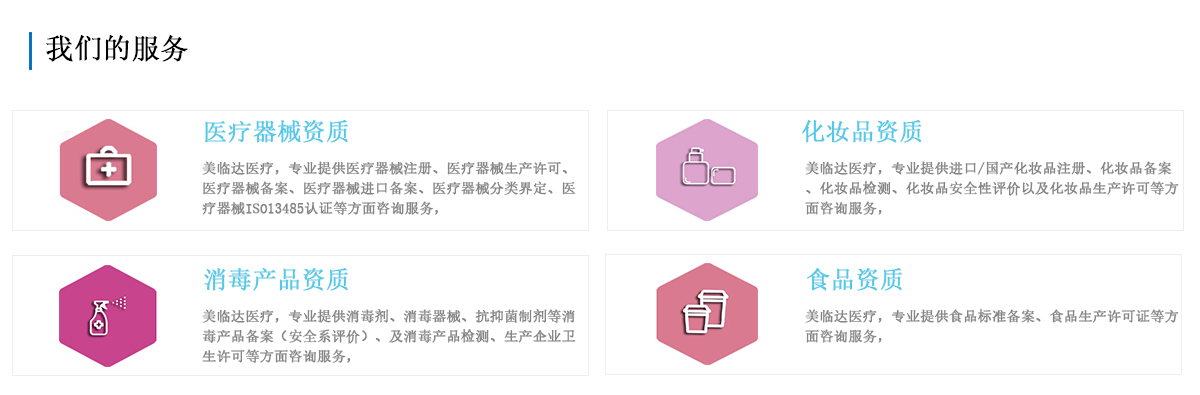
医疗器械资质
-----------------------------------------------
专、快、优、省